荧光定量PCR方法:染料法VS探针法
1. SYBR Green I 染料法原理:SYBR Green I是一种非对称花菁染料,能够结合于所有双链DNA双螺旋小沟区域,并不与单链DNA链结合。在游离状态下,SYBR Green I只能发出微弱的荧光,但与双链DNA结合后,荧光会大大增强。因此将SYBR Green I染料添加到PCR反应体系中时,SYBR Green I能够结合到模板和扩增产物发出荧光。随着每轮扩增,产物量呈指数型上升,荧光信号也随之累积并被仪器检测到。
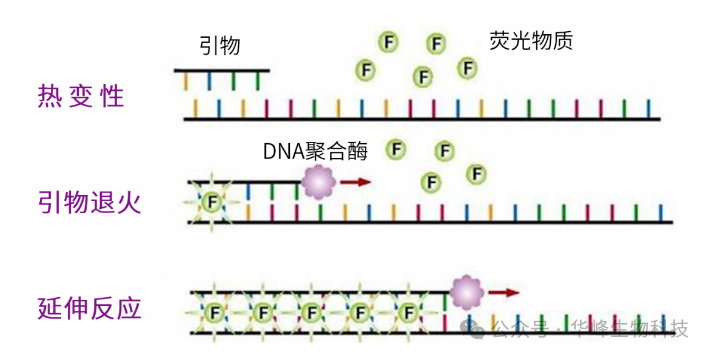
图1 SYBR Green I 染料法作用机理
2. 熔解曲线:设置由低温到高温的程序,如一段由65℃逐渐升温到95℃的程序,随着温度逐渐升高,DNA双链逐渐解链为单链,嵌入到双链中的荧光染料分子也会逐渐脱落下来,荧光信号强度逐渐下降。当达到DNA解链一半的温度,即到达Tm值时,荧光染料会大量游离出来,从而使荧光值迅速降低,最后转换成导数后形成高峰。
染料可以插入任何双链DNA,包括引物二聚物和非特异性产物。SYBR Green I染料法是利用染料在DNA解链时释放不发射荧光,而在DNA双链时与其结合发射荧光的原理制作熔解曲线,利用荧光染料可以指示双链DNA熔点的性质,通过熔点曲线分析可以识别扩增产物和引物二聚体,因而区分非特异性扩增。
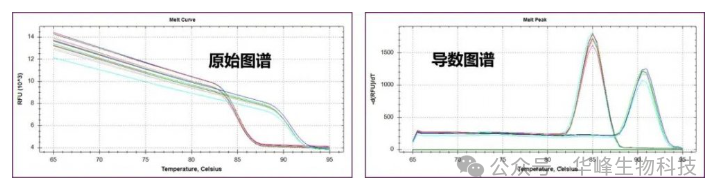
图2 熔解曲线
Taqman探针法原理:在PCR扩增反应加入一对引物的同时加入一个特异性的荧光探针(Taqman探针),该探针5’端标记一个荧光染料报告基团(Reporter, R),3’端标记一个淬灭荧光基团(Quencher, Q):
①开始时,探针完整地结合在DNA任意一条单链上,报告基团(R)发射的荧光信号被淬灭基团(Q)吸收,检测不到荧光信号;
②PCR扩增时,Taq酶的核酸外切酶活性将探针酶切降解,使报告基团(R)和淬灭基团(Q)分离,从而发出荧光,切割下来的荧光分子数与PCR产物的数量成正比。因此,可以通过检测PCR反应体系中的荧光强度检测PCR产物的扩增量。
Taqman探针在PCR反应时其寡核苷酸链由于被DNA聚合酶的外切酶活性给切断,所以不会重新再结合形成探针,且特异性很高(特异性探针加特异性引物的结合的片段上发生扩增才能收集荧光信号),所以不需要做熔解曲线。
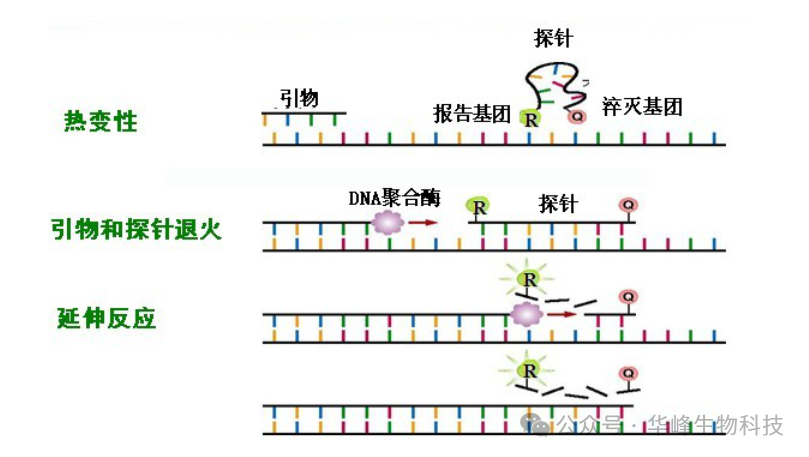
图3 Taqman探针法作用机理
华峰生物水产检测试剂采用Taqman荧光探针法,特异性强、灵敏度高,其检测限低至几个拷贝,更好地帮助养殖企业了解目标病原体的携带情况、指导提前预防或及早检出,避免造成较大经济损失。
Taqman探针法 | SYBR Green染料法 | |
特异性 | 高 | 中(容易产生假阳性) |
灵敏性 | 高 | 中 |
可重复性 | 高 | 中 |
通用性 | - | √ |
多重反应 | √ | - |
是否需要实验优化 | - | √ |
探针/引物设计 | 探针+引物 | 引物 |
实验成本 | 高 | 中 |
应用 | 特定基因表达差异分析 | 特定基因表达差异分析 |
DNA定量 | DNA定量 | |
SNPs基因分析 | - | |
基因突变检测 | - | |
产前诊断(遗传病检测) | - | |
传染病早期病原体检测 | - | |
新药研发与药效评价 | - | |
miRNA定量分析 | - |
(图文来源网络如有侵权请联系删除)